Maladie de Charcot : Symptômes, causes et traitements
La SLA (sclérose latérale amyotrophique) ou maladie de Charcot bouleverse la vie en quelques mois. Découvrez les symptômes, les causes, les traitements actuels et les espoirs thérapeutiques : Tout comprendre pour mieux l’affronter.
Sommaire
Maladie de Charcot : Maladie neurodégénérative
C’est quoi la maladie de Charcot (SLA) ?
Maladie de Charcot symptômes : Les signes cliniques de la maladie
Maladie de Charcot : Formes spinale et bulbaire
Causes de la Maladie de Charcot et facteurs de risque
Diagnostic et évaluation de la maladie de Charcot
Maladie de Charcot traitements et prise en charge
Vivre avec une maladie neurodégénérative
Sclérose latérale amyotrophique : Recherche et avancées thérapeutiques
Maladie de Charcot : Maladie neurodégénérative
Lorsqu’on évoque la « maladie de Charcot », on fait généralement référence à la Sclérose Latérale Amyotrophique (SLA), une affection neurologique grave qui transforme radicalement la vie des patients et de leur entourage. Cette pathologie, souvent méconnue du grand public jusqu’au phénomène du « Ice Bucket Challenge » en 2014, représente pourtant un défi majeur tant pour les patients que pour la médecine moderne.
Il est important de ne pas confondre la SLA avec la maladie de Charcot-Marie-Tooth, une neuropathie héréditaire qui, bien que portant partiellement le même nom, présente des mécanismes et une évolution totalement, différents. Cette distinction est essentielle pour comprendre le parcours spécifique des patients atteints de SLA.
C’est quoi la maladie de Charcot (SLA) ?
Définition et classification médicale
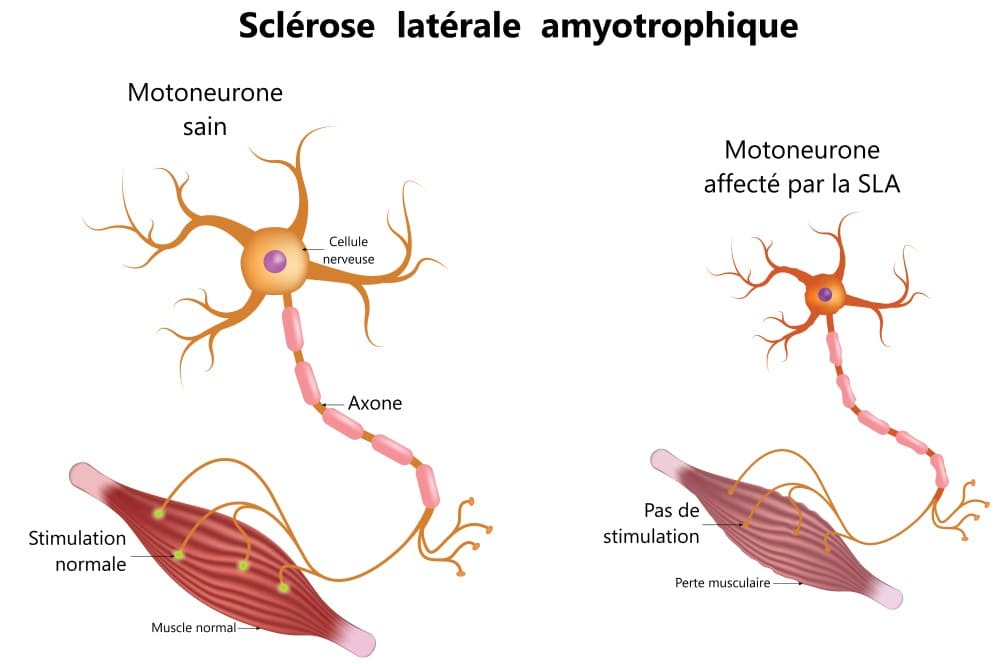
La Sclérose Latérale Amyotrophique est une maladie neurodégénérative progressive qui affecte les neurones moteurs responsables du contrôle des mouvements volontaires. Le terme « sclérose » fait référence au durcissement des tissus, « latérale » indique la localisation de l’atteinte dans la moelle épinière, et « amyotrophique » décrit l’atrophie musculaire qui en résulte.
En France, on estime qu’environ 5 à 7 personnes sur 100 000 sont touchées, avec près de 1 000 nouveaux cas diagnostiqués chaque année. L’âge moyen d’apparition se situe généralement entre 55 et 65 ans, mais la maladie peut frapper à tout âge adulte. Les hommes semblent légèrement plus touchés que les femmes, dans un rapport d’environ 1,5 pour 1.
Maladie de Charcot symptômes : Les signes cliniques de la maladie
SLA premiers signes :
La SLA se manifeste généralement de façon insidieuse, ce qui peut retarder le diagnostic. Les premiers symptômes varient d’une personne à l’autre, mais certains signes sont particulièrement évocateurs :
- Faiblesse musculaire asymétrique, souvent localisée initialement dans une main, un bras ou une jambe
- Crampes musculaires, particulièrement nocturnes
- Fasciculations (petites contractions musculaires involontaires visibles sous la peau)
- Maladresse inhabituelle dans les gestes quotidiens comme boutonner une chemise ou tourner une clé
Progression des symptômes
Au fur et à mesure que la maladie évolue, les symptômes s’aggravent et s’étendent à d’autres parties du corps. Cette progression peut être rapide chez certains patients, plus lente chez d’autres, mais suit généralement une trajectoire prévisible :
- D’abord, l’atteinte musculaire s’intensifie, entraînant une diminution progressive de la force et une atrophie visible. Les muscles touchés peuvent paradoxalement présenter une raideur (spasticité) qui complique encore les mouvements.
- Par ailleurs, des problèmes d’élocution (dysarthrie) et de déglutition (dysphagie) apparaissent lorsque les muscles bulbaires sont atteints. Ces symptômes peuvent survenir dès le début dans certaines formes de la maladie ou plus tardivement dans d’autres cas.
- Les difficultés respiratoires constituent souvent le problème le plus grave à mesure que la maladie progresse. L’affaiblissement du diaphragme et des muscles intercostaux entraîne une respiration inefficace, particulièrement durant le sommeil, avec potentiellement des apnées et une fatigue diurne accrue.
Découvrez également notre article sur liquide céphalo rachidien, que faire en cas de fuite ici
Maladie de Charcot : Formes spinale et bulbaire
La SLA présente différentes formes cliniques, ce qui explique parfois les variations dans le parcours des patients. On distingue deux formes majeures : La forme spinale et la forme bulbaire.
- La forme spinale, qui touche d’abord les membres, est la plus fréquente (environ 70 % des cas). Elle commence typiquement par une faiblesse dans les mains ou les jambes. J’ai suivi une patiente de 62 ans qui a d’abord remarqué qu’elle trébuchait fréquemment lors de ses promenades quotidiennes, bien avant que d’autres symptômes n’apparaissent.
- La forme bulbaire, quant à elle, affecte initialement les muscles contrôlés par le tronc cérébral. Les patients développent en premier lieu des troubles de la parole, une voix nasonnée et des difficultés à avaler. Cette forme progresse généralement plus rapidement et concerne environ 30 % des cas, touchant davantage les femmes.
- Les variations dans la vitesse d’évolution : Certains patients connaissent une progression rapide sur quelques mois, tandis que d’autres peuvent vivre plusieurs années avec des symptômes relativement stables. Ces différences restent partiellement mystérieuses pour les neurologues.
Causes de la Maladie de Charcot et facteurs de risque
Facteurs génétiques
Les avancées en génétique ont considérablement amélioré notre compréhension de la SLA ces dernières décennies. Environ 10 % des cas sont considérés comme « familiaux », c’est-à-dire avec une composante héréditaire identifiable.
Plusieurs mutations génétiques ont été associées à la maladie :
- La mutation du gène SOD1, découverte en 1993, responsable d’environ 20 % des formes familiales
- La mutation C9ORF72, identifiée plus récemment et représentant près de 40 % des formes familiales
- D’autres gènes comme TARDBP, FUS ou UBQLN2 qui contribuent également au risque
Les tests génétiques sont désormais disponibles pour les patients ayant des antécédents familiaux, mais la question de leur pertinence fait débat quand aucun traitement préventif n’existe encore.
Maladie de Charcot : Facteurs environnementaux suspectés
Bien que les causes exactes restent incertaines, plusieurs facteurs environnementaux sont suspectés de jouer un rôle dans le déclenchement de la SLA :
- L’exposition à certaines toxines environnementales, comme les pesticides ou les métaux lourds, a été évoquée dans plusieurs études épidémiologiques. Par ailleurs, certains chercheurs ont observé un taux plus élevé de SLA chez les vétérans militaires, suggérant un possible lien avec des expositions spécifiques durant leur service.
- La relation entre traumatismes physiques et SLA reste controversée. Des études ont suggéré que les sportifs de haut niveau, notamment dans les sports de contact comme le football américain ou la boxe, pourraient présenter un risque accru, mais ces données demeurent contestées dans la communauté scientifique.
Mécanismes biologiques impliqués
Au niveau cellulaire, plusieurs mécanismes pathologiques semblent contribuer à la dégénérescence des neurones moteurs :- Le stress oxydatif joue probablement un rôle central, avec une accumulation de radicaux libres qui endommagent les cellules nerveuses. Ce phénomène pourrait expliquer pourquoi certaines mutations comme celle du gène SOD1 (superoxyde dismutase), impliqué dans la détoxification des radicaux libres, sont associées à la maladie.
- On observe également un dysfonctionnement mitochondrial dans les neurones affectés, perturbant la production d’énergie cellulaire et contribuant à leur mort prématurée. Ce processus est souvent accompagné d’une agrégation anormale de protéines, formant des amas toxiques à l’intérieur des cellules nerveuses.
Diagnostic et évaluation de la maladie de Charcot
Processus de diagnostic de la SLA
Le diagnostic de la SLA reste essentiellement clinique et souvent complexe. En l’absence de biomarqueur spécifique, il repose sur un faisceau d’indices et l’exclusion d’autres pathologies.
- L’examen neurologique détaillé constitue la pierre angulaire du diagnostic. Le médecin recherche des signes d’atteinte des neurones moteurs supérieurs (hyperréflexie, spasticité) et inférieurs (fasciculations, atrophie musculaire) dans plusieurs régions du corps.
- L’électromyographie (EMG) est l’examen complémentaire le plus important. Cette technique permet d’évaluer l’activité électrique des muscles et de détecter des anomalies caractéristiques de la SLA. Une ponction lombaire peut également être réalisée pour analyser le liquide céphalo rachidien et exclure d’autres maladies inflammatoires (ou infectieuses) comme la sclérose en plaques ou la syringomyélie, par exemple, qui sont des maladies de la moelle épinière.
Imagerie médicale et biomarqueurs
- L’IRM cérébrale et médullaire est systématiquement pratiquée, moins pour confirmer le diagnostic que pour éliminer d’autres causes potentielles des symptômes (tumeurs, compression médullaire, sclérose en plaques…).
- Des techniques d’imagerie plus avancées comme l’IRM fonctionnelle ou la spectroscopie par résonance magnétique sont parfois utilisées en recherche pour mieux comprendre les mécanismes de la maladie, mais leur utilité clinique reste limitée.
- La recherche de biomarqueurs fiables dans le sang ou le liquide céphalo-rachidien fait l’objet d’intenses recherches. Certaines protéines comme les neurofilaments semblent prometteuses pour améliorer la précocité du diagnostic et suivre l’évolution de la maladie.
Maladie de Charcot : Diagnostic différentiel
Avant de confirmer un diagnostic de SLA, les neurologues doivent écarter de nombreuses autres affections qui peuvent présenter des symptômes similaires :
Les syndromes parkinsoniens atypiques, certaines neuropathies motrices multifocales, ou encore la myélopathie cervicale arthrosique peuvent parfois être confondus avec la SLA. De même, certaines maladies métaboliques ou intoxications peuvent mimer les symptômes initiaux.
Cette démarche d’exclusion explique pourquoi le délai entre les premiers symptômes et le diagnostic définitif peut atteindre 12 à 18 mois, une période particulièrement anxiogène pour les patients et leurs proches.
Maladie de Charcot traitements et prise en charge
Deux médicaments approuvés pour traiter la maladie
Face à la SLA, l’arsenal thérapeutique reste malheureusement limité. À ce jour, seulement deux médicaments ont obtenu une approbation pour traiter spécifiquement cette maladie.
- Riluzole : commercialisé depuis les années 1990, constitue le traitement de référence. Son mécanisme d’action repose sur la réduction de l’excitotoxicité liée au glutamate. Les études montrent qu’il prolonge la survie de 2 à 3 mois en moyenne, un bénéfice modeste, mais significatif dans le contexte de cette maladie. Plusieurs patients sous Riluzole témoignent de résultats variables : certains ne perçoivent aucun changement notable, d’autres ressentent un ralentissement subtil de la progression.
- Edaravone : Plus récemment approuvé, il agit comme un piégeur de radicaux libres pour réduire le stress oxydatif. Initialement développé au Japon, ce traitement a montré des résultats prometteurs chez un sous-groupe de patients aux stades précoces. Son administration par voie intraveineuse pendant 10 jours tous les mois représente cependant une contrainte significative.
Prise en charge multidisciplinaire
Bien plus qu’un simple traitement médicamenteux, la SLA nécessite une approche globale coordonnée par le neurologue. Les données montrent que les patients suivis dans des centres spécialisés multidisciplinaires bénéficient d’une meilleure qualité de vie et parfois même d’une survie prolongée.
- La kinésithérapie joue un rôle central pour maintenir la fonction musculaire aussi longtemps que possible. Les séances régulières, généralement 2 à 3 fois par semaine, visent à prévenir les rétractions et à entretenir les capacités respiratoires.
- L’ergothérapeute intervient parallèlement pour adapter l’environnement du patient et préserver son autonomie.
- L’orthophonie devient cruciale dès l’apparition des troubles de la parole ou de la déglutition. Un suivi nutritionnel attentif permet d’anticiper les besoins énergétiques spécifiques et de prévenir la dénutrition, complication fréquente qui aggrave le pronostic.
Dispositifs d’assistance et adaptations
À mesure que la maladie progresse, différentes aides techniques deviennent nécessaires :
- Pour la mobilité : Cannes, déambulateurs, puis fauteuils roulants manuels ou électriques
- Pour la respiration : Ventilation non invasive par masque nocturne puis, si nécessaire, trachéotomie avec ventilation permanente
- Pour l’alimentation : Adaptation des textures puis, souvent, mise en place d’une gastrostomie
Les technologies d’aide à la communication connaissent des avancées remarquables. Des dispositifs à commande oculaire permettent désormais aux patients de contrôler un ordinateur et de communiquer même lorsque tout mouvement volontaire est devenu impossible. Certains patients utilisent également des synthétiseurs vocaux personnalisés qui préservent leur « voix numérique » même après la perte de la parole.
Vivre avec une maladie neurodégénérative
Impact psychologique de la maladie de Charcot
L’annonce du diagnostic représente un véritable séisme émotionnel. Le processus d’adaptation psychologique traverse généralement plusieurs phases : Choc initial, déni, colère, puis acceptation progressive. Cette trajectoire n’est jamais linéaire et varie considérablement d’un individu à l’autre. L’anxiété et la dépression touchent environ 30 à 50 % des patients et nécessitent une prise en charge spécifique par des psychologues formés aux maladies neurodégénératives.
Certains centres proposent des groupes de parole qui offrent un espace précieux pour partager expériences et stratégies d’adaptation. La thérapie cognitivo-comportementale montre également des résultats intéressants pour gérer l’anxiété associée à la progression de la maladie.
SLA : Soutien familial et aidants
Les proches jouent un rôle fondamental mais se retrouvent souvent en première ligne face à une situation éprouvante. Le fardeau des aidants augmente graduellement, avec un risque d’épuisement physique et émotionnel que les professionnels de santé doivent savoir repérer.
Des solutions de répit comme l’accueil temporaire en institution spécialisée ou l’intervention d’équipes à domicile peuvent soulager momentanément les familles. Les associations de patients comme l’ARSLA en France offrent également un soutien précieux, tant informatif que logistique et émotionnel.
Fin de vie maladie de Charcot et soins palliatifs
La maladie de Charcot confronte inévitablement à des questions existentielles profondes. L’élaboration de directives anticipées, bien que difficile, permet au patient d’exprimer ses souhaits concernant les traitements de maintien en vie et les conditions de fin d’existence.
Les équipes de soins palliatifs interviennent idéalement dès les stades intermédiaires de la maladie, et non uniquement en phase terminale. Leur expertise en gestion des symptômes inconfortables (douleur, difficultés respiratoires, anxiété) améliore considérablement la qualité de vie.
Le débat sur la fin de vie et l’aide médicale à mourir reste particulièrement sensible dans le contexte de la SLA. Les positions varient selon les pays, les cultures et les convictions personnelles, mais la priorité devrait toujours rester le respect de la dignité et des choix éclairés du patient.
Sclérose latérale amyotrophique : Recherche et avancées thérapeutiques
Thérapies expérimentales prometteuses
La recherche sur la SLA connaît actuellement une effervescence sans précédent. Plusieurs pistes thérapeutiques novatrices sont en développement :
- Les thérapies géniques visent à cibler directement les mutations responsables des formes familiales. L’approche par ARN antisens pour neutraliser le gène C9ORF72 muté a montré des résultats encourageants en laboratoire. Des essais cliniques de phase 1 et 2 sont en cours pour évaluer la sécurité et l’efficacité de ces approches chez l’humain.
- Le potentiel des cellules souches fait également l’objet d’intenses recherches. Certaines études explorent leur capacité à remplacer les neurones moteurs détruits, tandis que d’autres s’intéressent à leur effet neuroprotecteur via la sécrétion de facteurs trophiques.
- L’intelligence artificielle révolutionne aussi la recherche en permettant d’analyser des quantités massives de données pour identifier de nouvelles cibles thérapeutiques.
Approches innovantes en développement
Au-delà des approches classiques, des stratégies novatrices émergent :
| Approche | Mécanisme | Stade de développement |
| Immunothérapie | Modulation de la réponse inflammatoire | Essais cliniques phases 1-2 |
| Thérapies basées sur l’ARN | Correction des anomalies de traitement de l’ARN | Études précliniques avancées |
| Approches métaboliques | Restauration du métabolisme énergétique neuronal | Essais de phase 2 |
Maladie de Charcot : La conclusion
La maladie de Charcot reste l’un des défis les plus redoutables de la neurologie moderne. Son impact dévastateur sur les patients et leur entourage contraste avec les options thérapeutiques encore limitées.
Néanmoins, des avancées significatives dans la compréhension des mécanismes biologiques sous-jacents et l’émergence de nouvelles approches thérapeutiques permettent d’entrevoir des perspectives plus encourageantes pour l’avenir.
En attendant des traitements plus efficaces, l’optimisation de la prise en charge multidisciplinaire et le soutien psychosocial représentent les meilleures stratégies pour préserver la qualité de vie des patients. L’importance de la recherche et de la sensibilisation du public reste fondamentale pour faire progresser notre réponse collective face à cette maladie.
Foire aux questions sur la maladie de Charcot
Est-ce que l’on peut guérir de la Maladie de Charcot ?
Non, malheureusement, cette maladie ne se guérit pas. Des traitements comme le Riluzole et l’Edaravone existent pour freiner la maladie.
« J’ai guéri de la SLA », est-ce possible ?
Comme indiqué ci-dessus, il n’est pas possible de guérir de cette maladie. La maladie de Charcot est une maladie neurodégénérative, qui paralyse le malade au fil du temps, ne lui permettant plus de se nourrir ni de se déplacer. Il sera assisté jusqu’à sa fin de vie.
Quelles sont les douleurs de la Maladie de Charcot ?
Des douleurs ou spasmes musculaires ainsi que des raideurs font partie de cette maladie neurodégénérative.